浙江圣希澳医学团队重大发现: 亲脂介质Maresin 1或为阿尔茨海默症新"克星"
作者:司马错 来源:网络 发布时间:2024-07-24 16:30阅读量:16645 会员投稿
阿尔茨海默症(Alzheimer's disease, AD)是导致老年人认知功能障碍的最常见原因,给患者、家庭和社会带来沉重负担。虽然AD的确切病因尚未完全阐明,但越来越多的证据表明,神经元丢失、β-淀粉样蛋白(amyloid-β, Aβ)沉积、tau蛋白过度磷酸化等经典病理特征都与慢性炎症反应有关,所以慢性炎症反应也是AD发病过程中的关键环节之一。《柳叶刀·神经病学》(Lancet Neurology)和《柳叶刀》(Lancet)杂志的研究综述指出,长期持续的神经炎症可能加速AD的进展,而解决炎症有望成为AD治疗的新策略[1,2]。
小胶质细胞是中枢神经系统的常驻免疫细胞,在AD的炎症反应中扮演着至关重要的角色。发表在《自然·遗传学》(Nature Genetics)上的多项大样本基因组关联研究显示,补体受体1(CR1)、髓细胞触发受体2(TREM2)、CD33等小胶质细胞表达的炎症相关风险基因与晚发AD高度相关[3-5]。因此,深入研究AD患者小胶质细胞的炎症反应机制并发现新的干预靶点,对于阐明AD的发病机制和开发新的免疫治疗策略至关重要。
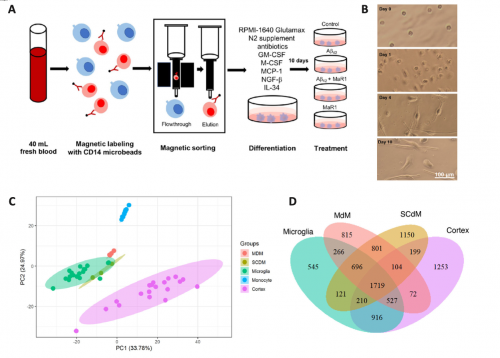
然而,由于伦理和技术等限制,直接从活体AD患者大脑组织分离原代小胶质细胞进行研究非常困难。为了克服这一障碍,圣希澳医学中心的Xiang Zhang (Dr.) 等研究者建立了一种新的人源化小胶质细胞模型,即利用从健康志愿者外周血中分离出的单核细胞,通过体外诱导分化获得的单核细胞衍生的小胶质细胞(monocyte-derived microglia, MdM)。这一模型为阿尔茨海默病的研究提供了新的有力工具。在最新一期《神经再生研究》(Neural Regeneration Research)杂志上,浙江圣希澳医学科技有限公司研究团队的Xiang Zhang (Dr.) 发表了了利用这一MdM模型,研究AD相关神经炎症及其解决机制的系列新发现,并首次探索了一种名为maresin 1(MaR1)的特殊亲脂介质对AD样炎症反应的调节作用(PMID: 38886959)。这一发现为开发新型AD治疗药物提供了潜在的候选分子,为AD患者带来新的希望。
该研究利用Aβ42多肽处理MdM细胞,成功构建了一个与AD患者脑内微环境高度相似的炎症模型。通过对MdM的转录组测序和炎症因子分泌谱分析,浙江圣希澳医学科技有限公司研究团队发现,Aβ42导的MdM炎症表型与AD患者脑内小胶质细胞的基因表达谱高度吻合。有趣的是,一种名为MaR1的特殊亲脂介质能够通过抑制炎症通路关键基因的表达特异性缓解Aβ42诱导的MdM炎症反应,使MdM恢复稳态。机制研究表明,MaR1主要通过重塑以NF-κB信号通路为核心的炎症转录调控网络,发挥神经保护和抗炎作用。该研究还鉴定了一系列新的分子靶标,它们既与AD神经炎症密切相关,又能介导MaR1的治疗效果,有望为开发新的AD免疫治疗策略提供线索。
张翔博士指出:"我们的研究首次证实,源自AD患者的MdM是一种高度相关的体外AD神经炎症模型,可用于筛选抗AD候选药物和研究患者个体化免疫治疗反应,这为今后开展以小胶质细胞为靶点的AD转化研究开辟了新的道路。" 张翔博士补充道:"maresin 1能够缓解Aβ42引起的多种AD相关炎症基因的表达改变,提示其通过重塑小胶质细胞炎症表型发挥治疗作用,有望成为一种全新的AD免疫治疗候选物。"
综上,这项发表在《神经再生研究》杂志上的研究提供了新的证据,支持MaR1及其他specialized pro-resolving lipid mediators (SPMs)可作为缓解AD神经炎症的潜在治疗策略。圣希澳医学中心团队不仅揭示了MaR1发挥神经保护作用的分子机制,还创新性地提出了MdM这一新型人源化AD小胶质细胞研究模型,为加速AD的机制研究和药物开发提供了新的研究工具,有望最终造福广大AD患者。
撰稿人:应雨诺
References:
[1] Heneka MT, et al. Neuroinflammation in Alzheimer's disease. Lancet Neurol. 2015;14(4):388-405.
[2] Scheltens P, et al. Alzheimer's disease. Lancet. 2016;388(10043):505-517.
[3] Naj AC, et al. Common variants at MS4A4/MS4A6E, CD2AP, CD33 and EPHA1 are associated with late-onset Alzheimer's disease. Nat Genet. 2011;43(5):436-441.
[4] Lambert JC, et al. Meta-analysis of 74,046 individuals identifies 11 new susceptibility loci for Alzheimer's disease. Nat Genet. 2013;45(12):1452-1458.
[5] Sims R, et al. Rare coding variants in PLCG2, ABI3, and TREM2 implicate microglial-mediated innate immunity in Alzheimer's disease. Nat Genet. 2017;49(9):1373-1384.
郑重声明:此文内容为本网站转载企业宣传资讯,目的在于传播更多信息,与本站立场无关。仅供读者参考,并请自行核实相关内容。


